امتصاص
الامتصاص (بالإنجليزية: Absorbtion)هو انتقال المادة الغذائية أو الدواء أو أي مادة أخرى تم تناولها من جوف الأمعاء ووصولها إلى الدوران العام.
آليات الامتصاص
الانتشار المنفعل Passive diffusion
الانتشار المنفعل وهو انتقال المادة بشكل تلقائي من الوسط ذي التركيز المرتفع إلى الوسط ذي التركيز المنخفض، وهذه العملية لقائية تتم دون الحاجة إلى طاقة.
وتمتاز المواد القابلة للانحلال بالدسم Lipophillic بأن امتصاصها يكون أسهل وأسرع عبر الأغشية الخلوية لبطانة الأمعاء الذي يمتاز بطبيعة دسمة. في حين أن المواد المنحلة بالماء Hydrophillic فلايمكن أن تعبر الغشاء الخلوي لبطانة الأمعاء، إلا من خلال قنوات خاصة موجودة فيه، تسمح له بالعبور.
النقل الفعال Active transport
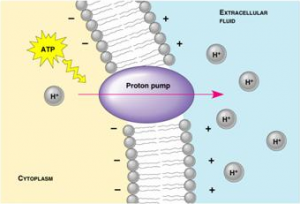
تتم عملية النقل الفعال العملية من خلال مجموعة من البروتينات الموجود على سطح الأغشية الخلوية لبطانة الأمعاء، حيث تقوم هذه البروتينات بنقل مواد معينة بذاتها من أحد جانبي الغشاء إلى الجانب الآخر.
العوامل المؤثرة على الامتصاص
درجة الحموضة
قابلية الانحلال بالدسم
امتصاص الأدوية
أهداف امتصاص الدواء OBJECTIVES OF DRUG ABSORPTION
يمكن تعريف الامتصاص على أنَّه العمليَّة التي تحدَّد المركبات التي تخترق واحد أو أكثر من الأغشية الخلوية وذلك لتتمكن من الدُّخول إلى الجسم. يجب عدم الخلط بين الامتصاص والتَّوافر الحيوي الذي يصف دخول المركبات الموصوفة إلى الدَّوران الجهازي . من الممكن أن يكون الامتصاص والتَّوافر الحيوي متماثلان بالنسبة لبعض الأدوية وسرعات الجرعات وذلك يكون مثل حالة الجرعة الوريدية. ومع ذلك فهما ليس كذلك في العديد من الحالات. بالنسبة للدواء الذي لا يخضع لأيّ تحوُّل استقلابي بين موقع مباشر تالي للامتصاص والدخول إلى الدوران الجهازي ، فإن الامتصاص والتوافر الحيوي يكونان متماثلين على الأرجح . يعبر جميع الدواء الممتص الدوران الجهازي وذلك بغض النظر عن إمكانية تعرض الدواء للتدرُّك أو التغيير ببعض الطرق الأخرى أي : قبل الامتصاص .
ومن ناحية أخرى ، فإنَّ أي دواء يتدرَّك في موقع ما بين الموقع ما بعد الامتصاص والدُّخول إلى الدَّوران الجهازي ، فإنَّ التَّوافر الجهازي _ التَّوافر الحيوي _ سوف يكون أقل من الامتصاص . إنَّ الدَّواء المعطى فمويَّاً يجتاز المرور الكبدي الأول الواسع وذلك من الممكن أن يؤدي إلى انخفاض في التوافر الحيوي الفموي على الرغم من أنه يمتص بشكل فعّال من السّبيل المعدي المعوي إلى الدوران الحشوي .
إن ملامح الفعالية الدوائية للتأثير الجهازي للدواء هي وظيفة من نشاطه داخلي المنشأ وصقات التركيز المنجزة في الدوران . إن سرعة بداية التأثير، والكثافة ،ومدة الفعالية عبارة عن دلائل لمظهر التركيز . تُحدد سرعة بدء تأثير الدواء بوساطة سرعة امتصاص الدواء وفي الحالات الطرفية التي يتم فيها استخدام بُلعة حقن وريدي والتي لها تأثير فوري وأعلى تأثير دوائي عادةً وتوفر التحرر المضبوط والبطيء للدواء، وفي التحرر البطيء الذي ليس بالضرورة أن يكون عن طريق الفم حيث تكون بداية التأثير طويلة وبطيئة وذلك لتحقيق الصفات العلاجية المرغوب بها. تتبع قوة التأثير الدوائي عادة للتركيز الدوائي الواصل إلى الدوران . إن العلاقة الحقيقة بين الحرائك الدوائية والديناميكية الدوائية غالباً ما تكون معقَّدة ولكن يمكن تعميم أن تراكيز الدواء الدورانية العالية تؤدي إلى تأثير أقوى .
تتبع مستويات الدواء الدَّوراني المحقق لكل من الجرعة ونجاعة الامتصاص والتوافر الحيوي الإجمالي والتوزُّع والتصفية clearance. إنّ المحدد الأكبر لحجم التوزع الدوائي هو قابليته للانحلال بالدسم. فكلما زادت الانحلالية بالدسم، ازدادت قابلية الدواء لعبور الأغشية الحيوية والتحرك إلى المحيط خارج الوعائي وخاصة إلى النسج الشحمية والجهاز العصبي المركزي CNS. ترتبط العديد من الأدوية ببروتينات البلازما وخاصة بألبومين البلازما ولكن بالرغم من أن ارتباط الأدوية ببروتينات البلازما ديناميكي وعكوس، فإنَّ أي دواء مرتبط بوقت محدد مقيد حتماً بحجم البلاسما وهكذا فإنها لا تستطيع أن تشارك في التوزع خارج الأوعية .
إن التصفية clearance هي العامل الأخير المؤثر بمستويات الدواء بالدوران. وتقل مستويات الدواء بالدوران كلما كانت تصفيته أسرع نتيجة للاستقلاب أو أية عمليات أخرى (أي كلما نقص عمر نصف إطراحه). المستويات الدورانية الأعلى تكون صعبة التحقيق عندما تكون التصفية الدوائية عالية منها مع التصفية الدوائية المنخفضة، كما أنه من غير المحتمل أن يحدث تراكم دوائي بوجود تصفية دورانية عالية وتكرار بالجرعة .
وهكذا فإن ظاهرة امتصاص الدواء هي واحدة وإن لم تكن الأهم من عوامل كثيرة تحدد خصائص الدواء في الدوران ومن المهم فهم كل هذه العوامل قبل خصائص الدواء وبخاصة العلاقة بين الحركية الدوائية pharmacokinetics والديناميكية الدوائيةpharmacodynamic التي تستطيع أن تميز بشكل كامل التأثير المتوقع للدواء .
تتبع كل من العوامل السابقة لخصائص الدواء الفيزيائية والكيميائية بينما يتأثر كل من التوزع والتصفية بخصائص الدواء فقط وبشكل عام لاتتغير إلا عن طريق حدوث بعض أنواع التآثرات* و يتأثر امتصاص الدواء والتوافر الحيوي بشكل ملحوظ بطرق إعطاء الدواء والشكل الجرعي والتشارك الدوائي مع مواد أخرى. و قد خصصت بعض الدفعات الكبيرة للبحوث الصيدلانية خلال العقدين الأخيرين للقضايا الأخيرة .
طرق إعطاء الدواء DOSAGE ROUTES
إن خصائص متطلبات امتصاص الدواء تتحقق من قبل تنوع طرق إعطاء الدواء . من الممكن تقسيم هذه الطرق إلى غير معوية ومعوية .وبناء على هذه الطرق المختلفة الهامة لطرق الإعطاء بهدف إيصال الدواء , والدوافع الحديثة لتحسين طرق الاعتماد لإيصال الدواء . عرضوا كلهم هنا بإيجاز .
- الطرق الحقنية:Parenteral Routes
إن طرق إيتاء الدواء الحقنية هي تلك الطرق التي لا تؤدي إلى ارتفاع في امتصاص الدواء بالدوران الحشوي splanchnic، و بالتالي فهي تتجنب إمكانية الاستقلاب بالمرور الكبدي الأول. و يجب ملاحظة أن بعض الطرق الحقنية لا تتجنب تأثيرات استقلاب المرور الأول الأخرى (مثل: الاستقلاب الجنبي pleural لبعض الأدوية الاستنشاقية). تتضمن بعض الطرق الرئيسية لإيتاء الدواء بالطريق الحقنيّ الطريق الشرياني و داخل القراب intrathecal و الوريدي intravenous و بطريق الأدمة transdermal و الأنفي و الشدقي buccal و الاستنشاقي و الصفاقي intraperitoneal و المهبلي vaginal و المستقيميّ rectal
- الطريق داخل الشرياني:Intra-arterial
يستخدم عادة الحقن داخل الشريان لإيصال الدواء إلى الأعضاء مباشرة، مثال : في المعالجة الكيميائية chemotherapy للسرطان، و في استخدام الفازوبريسين في حالات نزف الجهاز الهضمي. إنّ حقن الكارموستين داخل الشريان فعال لمعالجة الأورام السرطانية [1] كما يستخدم حقن الأكتينومايسين D بالشريان الحوضي pelvic intra-arterial لعلاج داء الأرومة الغاذية الخبيث trophoblastic.[2] إن إعطاء الدواء عن طريق الشريان تمتلك إمكانية نتائج آمنة، قد تم تقديم تقارير حول إمكانية حدوث الانصمام embolization، والانطباق الشرياني arterial occlusion، وسمية موضعية الدواء.
- الحقن داخل القراب:
يضمن الحقن داخل السائل النخاعي الشوكي مباشرةً توافر حيوي كامل داخل الجهاز العصبي المركزي للأدوية التي تستطيع عبور الحاجز الدموي الدماغي. تستخدم طرق التجريع هذه لعلاج العداوى الخطيرة في الجهاز العصبي المركزي كالتهاب السحايا والتهاب البطين وتستخدم مع عوامل للتخدير الشوكي مثل : مِيبيفاكايين والبيلوكاربين . إن الأدوية التي تحقن داخل القراب تنتشر مبدئياً فيما يقارب 140 مل من السائل الدماغي الشوكي لذلك فإن هذه الطريقة تعطي تراكيز عالية داخل الجهاز العصبي المركزي مع خطر سمية جهازية أقل .
- الطريق الوريدي(IV):
إن إعطاء الدواء وريدياً يؤدي إلى دخول الدواء مباشرة إلى الدوران الوريدي. إن شكل مرتسم الدواء الدوراني الناتج يحدده كل من الحجم والسرعة ومدة الحقن. تستخدم بلعة وريدية من أجل التأثيرات العلاجية المباشرة، ونموذجياً للتخدير العام ولمعالجة اضطراب نظم القلب cardiac arrhythmia كما أن الجرعات الوريدية شائعة الاستخدام خلال تطوير الدواء من أجل الفحوص ما قبل السريرية للمركبات وأيضاً كمقياس لتحديد التوافر الحيوي المطلق بالنسبة لطرق التجريع الأخرى.
- الطريق العضلي(IM):
يجب أن تعبر الأدوية بعد الحقن العضلي غشاء حيوي واحد أو أكثر للوصول إلى الدوران الجهازي. يستخدم الحقن داخل العضلي بشكل أساسي من أجل الأدوية واللقاحات التي لا تمتص فموياً كالأمينوغْليكُوزيد والأنسولين ولقاحات التهاب الكبد. إن سرعة الطريق داخل العضلي تستخدم عادة للعلاجات المساعدة والسواغات المتخصصة التي تتطور لتقديم توصيل بطيء للأدوية بهذا الطريق كالمستعلقات المائية والسواغات الزيتية والمعقدات والمحافظ من رتبة الميكرون microencapsulation.[3]
- الحقن عن طريق الأدمة:Transdermal
منذ إدخال المعالجة تحت الأدمية للسكوبولامين [4]، تم تطويرالعديد من نظم الإيتاء بطريق الأدمة للفعالية الجهازية . تتضمن أهم إيجابيات طريق الإيتاء هذا الإطلاق المستمر للدواء خلال وقت محدد وتصفية قبل جهازية قليلة وإمكانية سحب الدواء بسهولة بالنزع البسيط لجهيزة إيتاء الدواء، كما أنها ملائمة للمريض. تعود بعض المساوئ هذا الطريق إلى الخصائص الحائلة للجلد والتآثرات الجلدية وكبر حجم الجرعة نسبياً. يكون التوصيل عن طريق الأدمة خيار فعّال فقط في الأدوية التي تعطى بشكل عام بجرعات صغيرة (أقل من 10 ملغ )، والتي تملك خصائص اختراق جيدة للأغشية. تتضمن الأدوية المعتمدة عموماً الكلونيدين والاستراديول والنيكوتين والنتروغليسرين والسكوبولامين.
- الطريق الأنفي:Intranasal
من الممكن أن يستخدم طريق تطبيق الدواء بالطريق الأنفي للتأثيرات الجهازية أوالموضعية. تتضمن التأثيرات الموضعية معالجة الحساسية الأنفية والتهاب الأنف rhinitis واحتقان الأنف. أثبتت طرق التطبيق الأنفية للتأثيرات الجهازية فعاليتها من أجل أعداد قليلة من الأدوية و يتم اختبارها من أجل استخدام العديد من الادوية الأخرى. إن البنية المتطورة والوظيفة المتخصصة لطرق التهوية والأغشية الموجودة في التجويف الأنفي وأيضاً المنطقة السطحية الصغيرة لهذه المنطقة ممكن أن تحد من قدرة إيتاء الدواء . ويجب أن يؤخذ بعين الاعتبار تأثير التعرض المزمن للدواء على سلامة الأغشية الأنفية. ومما قد يزيد هذه المشكلة، الحاجة إلى عوامل فاعلة بالسطح لتحقيق اختراق جهازي جيد لهذا الطريق الجرعي. على الرغم من هذه العوامل فإن الخواص الفيزيائية لهذه المركبات من أجل امتصاص أنفي أمثل هي نفسها بالنسبة لطرق الامتصاص الأخرى، حيث يجب أن ينحل الدواء في السائل المخاطي الأنفي كما يجب أن يكون منحل بشكل كافٍ في الدسم حتى يعبر الغشاء الأنفي الظهاري . إن الامتصاص الأنفي مسهَّل بسبب النفاذية العالية للوُرَيْد والشعريات المرتبطة بالوُرَيْد. اعتمدت أجهزة الإيتاء المتنوعة طريق إيتاء الأدوية الأنفي لتطبيق القطرات و الضبائب و الرذاذات nebulizers والمطارسmatrices.[5] تعتبر الجزيئات الببتيدية الصغيرة ملائمة لطريق التوصيل الأنفي كما أن مُضاهِئات الفازوبريسين والأوكْسِيتُوسين متاحة تجارياً للجرعات الأنفية . تخضع ناهضات ومناهضات الهرمون المطلق للموجهة الدرقية ومناهضات الفازوبريسين الأخرى والببتيدات للاختبار . لقد حقق الطريق الأنفي نتائج مبهرة لدى الحيوانات بالنسبة للهرمونات الجنسية. وقد تم اختبار إيتاء الأنسولين بهذا الطريق لكنه لاقى نجاحاً متوسطاً.
- الطريق الشدقي:Buccal Route
لقد تبينت المعرفة البدائية للامتصاص تحت اللساني والشدقي من خلال استعمال النتروغليسرين بهذه الطرق وذلك بهدف معالجة هجمات الصداع والإسعاف في الذبحة الصدرية . من الممكن أن يمتص الدواء لوحده من خلال التجويف الفموي أو تحت اللسان . يظهر بشكل واضح أن الامتصاص تحت اللسان أسرع من الطرق الأخرى وذلك بسبب أغشية تحت اللسان والتغذية الدموية الغزيرة. إن متوسط باهاء اللعاب تقريباً 6 لذلك فإن امتصاص الأدوية يكون على الأرجح منفعلاً بشكل طبيعي كما أنها تكون مساعدة للجزيئات الثابتة و الحموض ذات قيمة pKa أكبر من 3 والأسس ذات قيمة pKa أقل من 9. تتضمن المركبات التي تم تسويقها للإعطاء بالطريق الشدقي أو تحت اللساني كلاً من النترات العضوية والباربيتورات والبابافيرين والتريبسين وبروكلوربيرازين والبينزوديازيبنات وبُوبْرينُورْفين والتريبسين و كابتوبرِيل و ايزوبرينالين و أوكسيتوسين و نِيفِيدِيبِين. حالياً يعتبر الأوكسيتوسين هو الببتيد الوحيد المسوّق للإعطاء تحت اللسان. ويتم اختبار تطبيق الستيروئيدات تحت اللسان وقد لاقت نجاحاً متوسطاً.
- طريق الاستنشاق:Inhalation
عندما تكون المادة مستنشقة فإنها تكون معرضة لأغشية الأنف أو الفم والبلعوم والرغامى والقصبات الهوائية والشعيبات والأكياس الهوائية والأسناخ (الشكل-1-). تمتلك الرئة مساحة سطح امتصاص حوالي 70 متر مربع أي أكبر من سطح امتصاص المعي الدقيق ومع ذلك فقد اعتمدت الرئة والطرق الهوائية المرتبطة بها لمنع الوصول المركبات الموصوفة إلى سطوح الرئة المحيطية عالية الامتصاص. لقد صمم الجهاز لمنع الوصول إلى المادة الجزيئية. ومع ذلك فإن تمكنت المواد من الوصول إلى المنطقة المحيطية من الرئة فإن الامتصاص سيكون فعال جداً. يتحكم كل من حجم الجزيئات وسرعة تطبيقها بمدى اختراق المواد المستنشقة لحيز المسلك الهوائي. إن الحجم الأمثل للجزيئات حتى تستطيع اختراق المسلك الهوائي بعمق يكون بحدود 3-5 ميكرومتر وستميل الجزيئات الكبيرة للتوضع بالمسالك الهوائية العليا. تستطيع معظم الجهائز الإنشاقية inhalation devices إيتاء 10% تقريباً من الجرعة المطبقة إلى السبيل التنفسي السفلي. لقد تطورت العديد من الوسائل بهدف زيادة الإيتاء الرئوي. حيث وصل إيتاء الدواء لـ 21% عند استخدام المنشقة ذات الضغط pressurized metered dose inhaler. [6] وبالرغم من هذه المحاسن مازال إيتاء الدواء رئوياً غير فعال. من الممكن أن يتثبط التوافر الجهازي للأدوية المستنشقة عن طريق استقلاب المرور الرئوي الأول . تحتوي الرئة على العديد من أنزيمات استقلاب الدواء والتي تتضمن مزائج لوظائف الأكسيداز والأكسيداز أحادي الأمين والاستراز. تستعمل عدة نماذج من الحيوانات لاسيما الجرذ والأرنب والكلب في دراسة استنشاق الأدوية.
- الحقن داخل الصِّفاق:Intraperitoneal
ليس من الشائع تطبيق الأدوية داخل الصفاق. يستخدم طريق الإيتاء هذا غالباً لإدارة وتطوير المركبات المكتشفة قبل السريرية preclinical وقد اقتصر استخدامها سريرياً بالمعالجة الكيميائية لأورام الاكتناف الصفاقية. يتكرر حدوث التهاب الصفاق peritotonotis عند مرضى التلف الكلوي الذين يتلقون المعالجة بالتحال الصفاقي الجوال المستمر(CAPD). إن التهاب الصفاق غالباً مايكون مترافق مع عدوى جهازية لذلك يجب تحقيق مستويات علاجية من المضادات الحيوية في كلا التجويف الصفاقي وداخل الدوران الجهازي . من الممكن أن تعطى الأدوية فموياً أو حقناً وذلك لتحقيق مستويات جهازية كافية على أمل أيضاً إنجاز مستويات علاجية في التجويف الصفاقي ، وكبديل لذلك من الممكن أن تطبق الأدوية مباشرة داخل التجويف الصفاقي بهدف الوصول لمستويات جهازية عن طريق الامتصاص الصفاقي .[7] وبناء على معرفة المؤلف فإن هناك القليل من المعلومات الواضحة حول الكفاءة النسبية لهذه البدائل .
- الطريق المهبلي:Vaginal
يبلغ طول القناة العضلية الليفية في المهبل البشري 10-15 سم تمتد إلى أعلى وخلف الفرج vulva وأخفض عنق الرحم uterine cervix. تكون التغذية الدموية للمهبل عن طريق الشريانين الرحمي والفرجي ويكون الارتشاح من المهبل عن طريق ضفيرة غنية التي تتدفق إلى داخل الوريد الحرقفي الغائر . يحافظ سطح الظهارة المهبلية على رطوبته عن طريق الإفرازات العنقية . إن باهاء السائل المهبلي بين 4-5 . يستخدم إيتاء الدواء عن طريق المهبل من أجل التأثيرات الموضعية ولكن يستطيع الامتصاص المهبلي أن يرتقي إلى سرعة وفعالية الإيتاء الجهازي. إن الامتصاص الجهازي الجيد وأيضاً قدرة المهبل على تثبيت جهائز الإيتاء، تؤثر في العديد من صيغ الأشكال الجرعية المهبلية وخصوصاً موانع الحمل الستيروئيدية steroid contraceptives. يتوفر عدد كبير من الأشكال الجرعية المهبلية مضبوطة التحرر متضمنة الحلقات المهبلية و الكرات الميكروية بَيولوجيُّ التَّدَرُّك biodegradable microspheres.
- الطريق المستقيمي:Rectal
يتراوح طول المستقيم البشري من 15-20 سم. يكون فارغاً بشكل طبيعي ويحتوي على 2-3 مل من السائل المخاطي ذو الباهاء من 7-8 كما أنه لا يحتوي على زغابات villi وذو مساحة امتصاص سطحية محدودة بحوالي 200-400 سم2. تكون الطبقة تحت لمخاطية بالمستقيم غنية بالأوعية الدموية واللمفية. يكون تصريف الوريد من المستقيم العلوي upper rectum إلى الدوران البابي portal circulation بينما يتم تصريف الوريد من المستقيم الأوسط والسفلي مباشرة في الوريد الأجوف السفلي inferior vena cava كما يوجد العديد من التفاغرات anastomoses الممتدة بين هذه الأوردة مما يسبب صعوبة في تمييز التشريح الدقيق. يبدو أن المركبات التي يتم امتصاصها في المستقيم السفلي تتجنب استقلاب المرور الاول الكبدي على عكس المركبات التي يتم امتصاصها في المستقيم العلوي. عادة يكون الامتصاص المستقيمي أبطأ من الامتصاص الفموي ولكن يفترض أن يتفوق الامتصاص المستقيمي على الامتصاص الفموي بسبب تجنب المرور الأول الكبدي بعد الإيتاء المستقيمي من أجل بعض الأدوية مثل المورفين والمِيتوكلوبراميد والأرغُوتامِين والليدوكايين والبروبرانولول. حيث يكون التوافر الحيوي الجهازي المستقيمي عند البشر من أجل الليدوكايين واسع الاستقلاب 65% بالمقارنة مع النسبة 30 % بعد الاعطاء الفموي.[8] عادة يكون الامتصاص المستقيمي للأدوية بالمحاليل المائية أو الكحولية أكبر من التحاميل suppositories. تنقص المواد غير الفاعلة على السطح كالساليسيلات الامتصاص المستقيمي للأدوية المنحلة بالماء وللمركبات ذات الوزن الجزيئي المرتفع أيضاً كالأنسولين والهيبارين واللألأغاسترين]].
فيزيولوجيا السبيل الهضمي: Physiology of the GI Tract
يعرض (الشكل -2- ) باهاء شتى مناطق السبيل الهضمي من منطقة الفم ذات الحموضة الخفيفة، تدخل المركبات المنطقة الأكثر حموضة في المعدة . تكون الحموضة نتيجة لإفراز حمض كلور الماء من الخلايا الجدارية للمعدة partietal cells. وتقوم الحموضة بدور مهم في عملية هضم الطعام عن طريق تسهيل تحويل مولدات الببسين ومولدات الأنزيم zymogens إلى أنزيمات فعالة حالّة للبروتينenzymes proteolytic. تميل البيئة الحامضة في المعدة إلى دعم الامتصاص المعدي للأدوية الحامضة شرط أن تكون الأدوية بشكلها المنحل. ومن ناحية أخرى، تميل الأدوية الأساسية إلى الانحلال مباشرة في المعدة لكن من الممكن أن يتثبط الامتصاص بسبب تحوّل الأدوية لشكلها المتشرّد وبذلك لن تكون الذوبانية في الدسم كافية لاختراق فعال للأغشية. من الممكن أن تزيد البيئة الحامضة في المعدة من انخفاض امتصاص الأدوية بسبب تدرّك الحفّاز الحامضي. إذا كان الدواء سائلاً أو منحلاً في المعدة وإذا كان ذوّاب في الدهن وثابت في البيئة الحامضية فسيكون قابل للامتصاص بفعالية بالمعدة . إن الكحول الإيتلي عبارة عن سائل مزوج تماماً بالماء ولديه ألفة للشحم كافية لعبور الأغشية الحيوية لذا فهو يمتص من المعدة .بعد عبور مصرة البواب فإن المركبات تصل إلى الأثناعشرى والصائم jejunum واللفائفي ileum. تختلف هذه المناطق من المعي الدقيق عن المعدة من جهة الباهاء ووجود الأنزيمات الهاضمة ومساحة سطح الامتصاص. يسبب إفراز الصفراء القلوية إلى الأثناعشرى ارتفاع الباهاء في الأثناعشري ومحتويات الأمعاء القاصية حتى 5-6 . يسبب اختلاف الباهاء من الحمضية إلى القلوية المعتدلة العديد من التغيرات في امتصاص الدواء. فالتلبيس المعوي الذي كان غير نفوذ بالمعدة سوف ينحل. كما ستنحل الأدوية الحمضية بسرعة أكبر وعلى الرغم من أن الباهاء لن تكون عالية بشكل كافٍ لمنع الذوبان أو أن تسبب ترسب الأدوية ذات القلوية الضعيفة . بنية وحركية الجهاز الهضمي: GI Structure and Motility إن المعدة عبارة عن عضو له شكل الجيب مبطن بسطح ظهارة ملساء نسبياً. بالرغم من إمكانية امتصاص المركبات من المعدة فإن مساهمة هذا العضو بسيطة في امتصاص الأدوية. إن الخصائص الامتصاصية للأمعاء الدقيقة الدانية أعلى من المعدة وأي منطقة من السبيل الهضمي. إن سرعة المركبات التي تعبر من المعدة إلى الأمعاء الدقيقة هي الخطوة المحددة لسرعة ضبط تحرر الدواء. إن حركية المعدة معقدة وخاضعة لتأثير المنبهات stimuli الهرمونية والعصبية. تتبع سرعة الإفراغ المعدي لتقلصات نظمية بتكرار ثلاث مرات في الدقيقة تقريباً عند الشخص الصائم وتكون أقل عندما يدخل الطعام إلى المعدة. تعبر الأطعمة من المعدة إلى العفج كنتيجة لهذه التقلصات النظمية وكلما كانت الوجبة أثقل وغنية بالدهون كلما ازدادت مدة إفراغ الوجبة والدواء المتناول معها للمعي الدقيق. تعتبر هذه العملية آلية دفاع تمنع المواد من الدخول للأمعاء الدقيقة الدانية وإيذاء السطح الامتصاصي الأملس لهذه المنطقة إلى أن تقوم بتقليل اللزوجة الملائمة للمعدة.
في حين أن الأطعمة الصلبة تؤخر من الإفراغ المعدي فإن السوائل تسرع من هذه العملية. ينتج التسريع من تنشيط مستقبلات الشد stretch receptors في جدار المعدة. عندما يكون السائل هو الماء، يتوقف تنشيط مستقبلات التثبيط inhibitory receptors ويؤدي ذلك إلى الإفراغ السريع لمحتويات المعدة إلى الاثناعشري. إلى حد بعيد فإن الاختلاف الأكثر أهمية بين المعي الدقيق الأدنى والمعدة هو طبيعة سطح الظهارة المخاطية. يتزايد السطح المخاطي من الأمعاء الدقيقة عن طريق البروزات أصبعية الشكل أو الزغابات والتي تقوم بزيادة طَيَّاتُ كيركرينغ folds of Kerckimg وعن طريق الزغيبات microvilli التي تنشأ عن الزغابات . تزيد الانغلافات invaginations من منطقة سطح المخاطية المعوية لحوالي 600 والتي تلتف إلى حوالي 200 م2 ويعبر الدم الذي خلال الشعريات المعوية بمعدل 1 -1.5 لتر / دقيقة. إن القيم المطابقة للمعدة هي فقط 100 م2 لسطح الامتصاص وسرعة التدفق الدموي هي 1450 مل /دقيقة ، وهكذا فإن الأمعاء الدقيقة تملك منطقة سطحية أكبر بضعفين تقريباً منها في المعدة وتكون معدل التروية الدموية أسرع بـ 6-10 مرات. حيث يميل كلا هذين العاملين القويين لزيادة الفعالية الامتصاصية للأمعاء الدقيقة . تبطن الزغابات والزغيبات في الأمعاء الدقيقة بالبروتين المخاطي الكبريتي والكنان السكري glycocalyx. إن كل من السائل المحصورمن قبل الكنان السكري المستقر وسلاسل الطبقات الرقيقة والتي تتهيج تدريجياً، تمتد إلى طور تعبئة لمعة الأمعاء. يبلغ ثخن هذه السلاسل من الطبقات غير الممزوجة حوالي 0.01-1 ملم . تتحرك الجزيئات في الطبقات غير الممزوجة عبر الانتشار بسرعة تتناسب عكسياً مع الجذر التربيعي للوزن الجزيئي دون وزن 450. وتتناسب عكسياً مع الجذر التكعيبي للوزن الجزيئي أعلى من وزن 450. إن الكنان السكري ذو شحنة سلبية ولديها شحنات متعاكسة في الطبقات غير الممزوجة. إذا كانت النسبة الأساسية في هذا الكاتيون مركبة من شوارد الهيدروجين والتي تكون الحالة الغالبة فإنه يدخل المناخ الدقيق إلى داخل حافَةٌ فِرْشاتِيَّة للظهارة والتي من المحتمل أن تكون حمضية بالنسبة إلى الطور الحجمي، وهذا قد يؤثر على تشرد الدواء في سطح الغشاء وبزود قاعدة "المناخ الدقيق الحمضي" المرتبطة غالباً مع مخاطية الجهاز الهضمي . تبقى المواد بالمعي الدقيق حوالي 5 دقائق بالاثناعشري و ساعتين في الصائم وحوالي 3-6 ساعات في اللفائفي ومن ثم تدخل المادة إلى الأمعاء الغليظة . لا يملك المعي الغليظ أي زغابات villi أو زغيبات في السطح المخاطي و تكون محتوياته معتدلة أو قلوية. لذلك فإن الامتصاص من المعي الغليظ يكون أقل فعالية منه في المعي الدقيق. يمتلك القولون والمعي الغليظ نبيت مجهري microflora بكتيري فعال يستطيع أن يدرّك الجزيئات الغريبة التي تقوم بتقليل امتصاص الأدوية في هذه المنطقة من السبيل الهضمي.
- إفرازات الجهاز الهضمي: GI Secretions
تتحكم الخلايا الجدارية بسرعة الإفراز الحامضي في المعدة. إن الأستيل كولين والغاسترين مهمين من أجل إفراز حمض كلور الماء وتؤثر مباشرة على الخلايا الجدارية بهدف زيادة سرعة الافراز الحامضي .
- مراحل إفراز المعدة الحمضي::Phases of gastric acid secretion
يختلف معدل الإفراز الحمضيّ خلال اليوم حيث يكون أعلى مايمكن في المساء وأقل مايمكن في الصباح كما يزداد معدل الافراز الحمضيّ في المعدة بعد تناول الطعام . تشمل الأطوار الثلاثة لازدياد الإفراز الحمضي نتيجة الاستجابة للطعام كلاً من الطور الرأسي (قبل وصول الطعام إلى المعدة) والطورالمعدي (تظهر نتيجة وجود الطعام في المعدة) والطور المعوي (تظهر نتيجة الدخول من الاثنا عشر وأعلى الصائم)
- الطور الرأسي: Cephalic Phase
يبدأ هذا الطور برؤية وشم و تذوق الطعام. يصل الإفراز الحامضي خلال هذا الطور حتى 40% من معدل الإفراز الأعظمي. تؤثر المحفزات الأخرى في الدماغ وبالإضافة إلى تلك التي تتعلق بوجود الطعام والتي قد تثير الإفراز الحامضي من خلال التأثيرات المبهمية vagal.
- المرحلة المعدية : Gastric Phase
يثير وجود الطعام في المعدة الإفراز الحامضي . تتضمن المنبهات الأساسية :تمدد المعدة ووجود الحموض الأمينية و الببتيديات . يحفز التمدد المعدي المستقبلات الميكانيكية والتي تسبب إفراز الأستيل كولين وحمض كلور الماء والغاسترين.
- الطور المعوي: Intestinal Phase
يحفز وجود الكيموس داخل الاثنا عشري الاستجابة الهرمونية (الصماوية) endocrine والعصبية التي تحفز وبمرحلة لاحقة، تمنع إفراز الحمض في المعدة. يسيطر تأثير الحفازات عندما يكون باهاء الكيموس المعدي أعلى من 3 . و لكن عندما تستنفذ سعة الوقاء buffer capacity وينخفض الباهاء إلى ما دون الـ 2 ، تصبح التأثيرات المثبطة هي المسيطرة .
- العصارة المعديّة: Gastric Juice
تتضمن المفرزات الهضمية مزيج من المفرزات من الخلايا الظهارية السطحية والغدد المعدية. تشكل الأملاح والماء والببسين والعوامل داخلية المنشأ العناصر الأساسية للعصارة المعدية . تزداد المفرزات الهضمية بعد الوجبة. يتعلق التركيب الأيوني للعصارة المعدية بمعدل الإفراز. يزداد معدل الإفراز بازدياد تركيز أيونات الهيدروجين. يختلف معدل الإفراز المعدي الحمضيّ من شخص إلى آخر .. تكون السرعة الأساسية عند الإنسان 1- 5 مل مكافئ / ساعة . كما أنه يرتفع النتاج الحامضي مع تحفيز الهيستامين أو بِنْتاغاسترين إلى 5-40 مل مكافئ / ساعة .
- الإفرازات الأخرى : Other Secretions
تنتج الصفراء ذات الباهاء 7.8 -8.6 بشكل مستمر في الجسم البشري. تتجمع صفراء الكبد وتتخزن في الحويصل الصفراوي بين الوجبات وتتدفق إلى داخل الاثنا عشر عندما يدخل الطعام إلى الأمعاء. إن المقومات الأساسية للصفراء هي الأملاح و بِيليروبين والمنتجات النهائية لتحلل الهيموغلوبين وكهارل الصوديوم والكلور و البيكربونات والكوليسترول و الفوسفوليبيدات و لِيسِتَين . تتقبض عضلات الحويصل الصفراوي كل 30 دقيقة بعد تناول الطعام بسبب تحرر الكُولِيسِيسْتوكِينين. يكون التأثير الفعال الأعظمي لهذه الحفازات عندما يكون الطعام غني بالدسم . ترفع الأملاح الصفراوية ذات الفعالية السطحية انحلالية الأدوية المحبة للدسم ومكونات الدواء المحبة للدسم الداخلة في تركيب الغلاف وقوالب الدواء الشمعية كما أنه من الممكن أن ترفع أملاح الصفراء نفاذية الأغشية للجزيئات المحبة للدسم من خلال تشكيل المذيلات والانحلالية . تتضمن العصارة البنكرياسية الأنزيمات والسائل القلوي و كلاهما يفرغ إلى الاثناعشري . تساهم قلوية الباهاء في تعديل الحموضة المفرغة من المعدة، تلعب أنزيمات الأميلاز والليباز والتريبسين والكيموتريبسين دوراً كبيراً في هضم الكاربوهيدرات والدسم والبروتين. يفرز التريبسين والكيموتريبسين على شكل طليعة غير فعالة وتتحول بوساطة الإنزيمات إلى الشكل الفعال ،ونتيجة لإفراز الأنظيمات الحالة للبروتين إلى الاثنا عشري فإن الأدوية البروتينية أو الببتيدية كالموجّهة القشريّة corticotropin والفازوبريسين والأنسولين سوف تتحلل بسرعة وعموماً لا يمكن إعطاؤها عن طريق الفم . يخضع نشاط البنكرياس الصفراوي للتحكم الهرموني والعصبي . لا تتواجد المفرزات المعوية بنفس غزارة الإفرازات المعدية أو البنكرياسية أو الصفراوية ، ومع ذلك يحدث تدفق كبير للسائل في كافة أنحاء الأمعاء. يظهر بأن أية مفرزات من مخاطية المعدة تملك تأثير مزلق وواقٍ
- تدفق دم الجهاز الهضمي ذو العلاقة بامتصاص الأدوية : GI Blood Flow in Relation to Drug Absorption
قد تنتقل الأدوية بعيداً عن الجانب المشيمائي (the serosal side)من السبيل الهضمي عن طريق آلية أو اثنتين . يزوَّد الجهاز الهضمي بشبكة من الشعريات الدموية من الدوران الحشوي(splanchnic circulation) . من الممكن أن تلتقط الأدوية من قبل الأوعية اللمفية في ظهارة epithelium الجهاز الهضمي وتنتقل عن طريق الجهاز اللمفي والذي يصرف المنطقة البطنية abdominal area إلى القناة الصدرية thoracic duct . يُمتص أي دواء عن طريق هذا الجهاز الذي يدخل الدوران الجهازي مباشرة ولا يتعرض للمرور الأول الكبدي. تظهر امتصاصية الغالبية العظمى من الأدوية بشكل مسيطر من قبل النظام الشعري المترافق the capillary system مع الدوران الحشوي، على الرغم من وجود كلاً من الشبكة الشعرية الدموية والجهاز اللمفي. يبدو أن السبب الذي يكمن وراء ذلك هو في سرعة التدفق النسبي للدم واللمف. تكون سرعة التدفق الدموي في الدوران الحشوي 1 -1.5 لتر/دقيقة أو 30% من نتاج القلب. ومن الممكن أن تزداد هذه السرعة إلى 2 لتر/دقيقة بعد تناول وجبة. بينما تكون سرعة تدفق اللمف خلال نفس المنطقة 1-2 مل / دقيقة فقط، ولكن من الممكن أن تزداد إلى 5-20 مل/دقيقة بعد تناول وجبة. وهكذا يتدفق اللمف في هذه المنطقة أقل من التدفق الدموي بحوالي 500-700 مرة تؤمن السرعة النسبية لتدفق الدم الحشوي شروط الاختراق الفعلي على الجانب المشيمي لظهارة السبيل الهضمي كما تضمن مدروج تركيز عالي. إن هذه الشروط ترفع الامتصاص الفعال إلى مجرى الدم أكثر من اللمف. يُمتص عدد قليل فقط من الأدوية عن طريق الجهاز اللمفي lymph system. تتضمن هذه الأدوية الأدوية ذات الوزن الجزيئي المرتفع التي لا تستطيع دخول الشعريات وجزيئات مخصصة كالستيروئيدات steroids .
- استقلاب المرور الاول الكبدي: Hepatic First-Pass Metabolism
تعبر غالبية الأدوية التي تمتص في المعدة والأمعاء إلى الدوران الحشوي والذي يؤدي إلى وريد الباب portal vein والكبد ومن ثم إلى الدوران العام . يجب أن تعبر المركبات الممتصة بهذا الطريق عبر الكبد وسوف تعمل بدايةً بتراكيز أعلى منها في الحالة التي تتوزع بالنهاية إلى الدوران العام وأي مكان آخر. ولأن الاستقلاب الكبدي هو الاول طبيعياً، فإن نسبة عالية من أي دواء فموي يستقلب كبدياً بشكل كبير ستيم طرحه خلال المرور الأول البدئي. من الممكن أن يمتص الدواء بشكل فعال من السبيل الهضمي ويكون توافره الحيوي قليل بالدوران العام كنتيجة لتصفية المرور الأول الكبدي ومثال على ذلك الأدوية عالية الاستخلاص والتي تتضمن أسِيبُوتُولُول و آلبْرينُولُول و دِيسِيبرامِين وايزوبروتيرينول و ليدوكايين.
آليات الامتصاص: Absorption Mechanisms
يجب أن تعبر الأدوية الموصوفة فموياً خلال عدد من الأغشية حتى تمتص إلى الدوران الجهازي. تختلف العديد من الأغشية الفيزيولوجية بالبنية والوظيفة ،وبالرغم من ذلك فإنه يوجد اتفاق عام يتعلق بالبنية الأساسية لغشاء الخلية .
- الغشاء الخلوي: The Cell Membrane
لقد عرضت البنية الأساسية للغشاء الخلوي في الشكل-3- [9] وهي عبارة عن غشاء ليبيدي ثنائي الجزيء بثخانة 5نانومتر والذي يفصل السائل داخل الخلوي عن خارج الخلوي. إن الليبيدات مكونة بشكل أساسي من الفوسفوليبيدات الفُسْفاتِيدِيل سِيرِين وفُسْفاتِيدِيل إِينُوزِيتُول phosphatidylinositol كما وتتركب من ستيرولات sterols وحموض دسمة مشبعة وغير مشبعة . تبدي نفاذية عالية للجزيئات الكارهة للماء hydrophobic ونفاذية قليلة للجزيئات المحبة للماء hydrophilic. يترافق الغشاء الخلوي مع بروتينات داخلية وخارجية المنشأ. تكون البروتينات الداخلية المنشأ بروتينات كروية globular proteins والتي تمتد على الأغشية المضاعفة وتعبر عادة الأغشية المضاعفة bilayer وتحتجز داخل الغشاء نتيجة الكراهية للماء و تآثرات الكهرباء الساكنة electrostatic interactions. يستطيع البروتين أن يشكل قنوات channels أو حوامل carriers أو مضخات pumps لتمكن الجزيئات القطبية من عبور الغشاء.
- العبور الغشائي: Membrane Transport
تم تحديد العديد من آليات عبور الأدوية للأغشية. ويعتبر العبور السلبي واحد منهم وتستعمل البقية بعض أنواع آليات النقل .
- النقل الغشائي المنفعل أو البسيط : Simple or Passive Membrane Transport
تعتمد هذه الآلية بشكل أساسي على الانحلال بالشحم و مدروج التركيز concentration gradient والتي تعتبر مسؤولة عن العبور الغشائي للغالبية العظمى من الأدوية . يكون مجال النفاذية الغشائية كبير جداً، تمتلك الجزيئات الكارهة للماء نموذجياً معاملات توزع مرتفعة بينما تكون منخفضة لدى الجزيئات المحبة للماء. تتحدد سرعة وجهة النقل من خلال مدروج تركيز المواد عبر الغشاء. تعبر الجزيئات ذات الحموضة أو القلوية الضعيفة الأغشية بسرعة أكبر مما تكون بالشكل غير المشرد. ومع ذلك فإن الانحلالية بالماء تكون أفضل من أجل الشكل المشرد. يجب أن يكون الدواء ضمن محلول solution حتى يكون قادر على عبور أي غشاء. تتعلق هذه الضرورة المتناقضة للذوبانية في كل من الماء والدسم بشكل دقيق بامتصاص الدواء وتشكل تحدياً مستمراً في التراكيب الصيدلانية .
- البروتينات الناقلة: Transport Proteins
تجتاز العديد من المواد ،و خاصة الجزيئات القطبية، الأغشية بسرعة أكبر من المتوقعة عن طريق الانحلالية و معطيات النفوذيّة. يستطيع البعض أن يعبر الأغشية بشكل معاكس لمدروج التركيز. تتعلق نفاذية الأغشية بشكل عالٍ وغير متوقع بالبروتينات الناقلة. وقد عرفت العديد من البروتينات الناقلة وتتابعت. أتاحت المعرفة الحالية تعريف عملي للبروتينات الحاملة كقنوات channels وحوامل carriers ومضخات pumps. وقد شرح الوضع الحالي لهوية وخصائص هذه الجمل من قبل Wright. [9]
- القنوات: Channels
يعتمد التخمين الأولي لوجود مسامّ مائية aqueous pores في الأغشية على نفوذية الغشاء العالية للجزيئات القطبية الصغيرة.على سبيل المثال، إن نفوذية الماء أكثر بـ 1000 ضعف وبالنسبة لليوريا (الكارباميد) urea أكثر من المتوقع بـ 10 – 100 ضعف. تقود هذه الأنواع من المشاهدات إلى التنبؤ بوجود قنوات مائية بنصف قطر حوالي الأربعة أنغستروم. القنوات المائية: Water channels تم إثبات وجود القنوات المائية باستنساخ ناجح للبروتينات أدى إلى زيادة نفاذية الغشاء المائية ويظهر ذلك في الكريات الحمراء erythrocytes وخلايا النبيبات الكلوية renal tubule.
- القنوات الأيونية: Ion Channels
تم تقديم الدليل على وجود القنوات الأيونية في الأغشية الحيوية في السبعينيات. وقد أجرى Neher و Sakmann أهم التجارب تقريباً. [10] اللذان قاما بتسجيل تيارات القنوات الشاردية في الألياف العضلية. وصفت العديد من القنوات الشاردية للصوديوم والبوتاسيوم والكالسيوم والكلور وكل منها يملك مواصلة نوعية وانتقائية أيونية كما تم وصف احتمالية الفتح. يمكن للفولتاج voltage أو اللجين ligand أن يتحكم بفتح القنوات الشاردية وهكذا صممت القنوات على أنها بوبات فولتاج voltage-gated أو بوابات لجينية ligand-gated. تمتلك كل من القنوات الأيونية خصائص فارماكولوجية معينة. إنّ قنوات الصوديوم ذات انتقائية للصوديوم أكبر بـ 12 مرة منها للكاتيونات cations الأخرى. إن قنوات الكالسيوم ذات انتقائية للكالسيوم أكبر بألف مرة منها للكاتيونات الأخرى.
- الانتشار المسهَّل: Facilitated diffusion
إن الانتشار المسهَّل عبارة عن تقنية بسيطة مقترحة لتفسير عبور المركبات الذّوّابة بالماء. تتجلى الصفات الرئيسية لنظام العبور هذا بزيادة نفاذية الغشاء عن المتوقعة من قبل معاملات التقاسم partition coefficients و يحدث الانتشار باتجاه مدروج التركيز الأقل كما أن العبور يكون قابلاً للإشباع saturable و يحدث تنافس بين المصاوغات isomers. يستخدم الانتشار المسهّل لتوضيح القبط الخلوي cellular uptake للسكاكر والحموض الأمينية amino acids. تم التعرف على ستة نواقل سكرية لدى الإنسان مع توزعات نسيجية مختلفة وحركيات الركيزة ونوعيتها. كما تم التعرف على عدد من الحموض الامينية الميسرة بالخلايا الثديية. من المحتمل أن يكون نظام L (System L) الذي ينقل الحموض الأمينية المتعادلة كاللوسين leucine والفينيل ألانين phenylalanine هو الأكثر شهرة.
- المضخات: Pumps
إن المضخات عبارة عن بروتينات تنقل الأيونات بشكل معاكس لمدروجات التراكيز الكيميائي الكهربائي الكامن electrochemical potential gradients التي تستخدم الأدينوزين 5-ثلاثي الفوسفات (ATP) كمصدر للطاقة. تحافظ مضخة الصوديوم بوتاسيوم على تراكيز الصوديوم والبوتاسيوم داخل الخلوي في الخلايا الحية كما أنها تضبط امتصاص الماء والملح من قبل الخلايا الظهارية epithelial cells الموجودة في الأمعاء intestine والكلية kidney. تنقل مضخة الصوديوم - البوتاسيوم ثلاث شوارد صوديوم نحو خارج الخلية مقابل شاردتين بوتاسيوم نحو داخل الخلية مستهلكة جزيئة واحدة من الـ ATP . تتسبب نتائج نسبة التقارن 3:2 بخسارة صافية لشوارد الصوديوم إلى دون المدروج الكهروكيميائي في الخلية ويحافظ على حجم الخلية. تحاول الأبحاث الضخمة حالياً توضيح بنية الأشكال المتماثلة المتنوعة ووحدات مضخات الصوديوم – بوتاسيوم.
- النواقل المشتركة والمبادلات: Cotransporters and Exchangers
يوجد العديد من الشوارد والجزيئات المتشردة المتراكمة في الخلايا بشكل معاكس لمدروج التركيز كقبط اليود iodine من قبل الغدة الدرقية thyroid gland وتراكم الحموض في خلايا الكبد وامتصاص السكاكر والفوسفات من قبل الأمعاء الدقيقة. تعرض الدراسات الحديثة إمكانية السيطرة على آليات النقل المشترك cotransport وفي كل الحالات التي اختبرت حتى الآن، فإنه يستخدم مدروجات أيونات الهيدروجين والصوديوم لدفع النواقل المشتركة وتحافظ مضخات الشوارد على هذه المدروجات. تقترن نواقل الغلوكوز عبر الحافة الفرشاتية للأمعاء الدقيقة مع نواقل الصوديوم ويتحكم مدروج الصوديوم بنقل السكر العسير uphill sugar transport.
- النواقل المشتركة: Cotransporters
تستخدم النواقل المشتركة مدروج أيونات الهيدروجين والصوديوم للتحكم بعبورالركائز. لقد وصفت العديد من النواقل المشتركة واستنسخت cloned وتسلسلت sequenced وتعبَّرت expressed وأحد هذه النواقل هي ناقلة الصوديوم –غلوكوز المشتركة التي شرحت قبل قليل. تسهل النواقل المشتركة الأخرى عبور السكاكر الأخرى والذائِبات الأُسْمولِيَّة osmolytes والحموض الأمينية. يحدث اضطراب الامتصاص المعوي للغالاكتوز والغلوكوز عند البشر بسبب وجود عيب في نواقل (الصوديوم – الغلوكوز).
- المنادلات التعاكسية: Antiporters
إن أفضل المنادلات التعاكسية المميزة أوالمبادلات exchangers هي مبادلات (كلور- بيكربونات) و شوارد (هيدروجين – صوديوم) ومبادلات (الكالسيوم – صوديوم). تتحكم مبادلات شوارد (الهيدروجين-صوديوم) الخلوية بالحجم الخلوي والباهاء والنمو ونقل الصوديوم . لقد استنسخت وتسلست النواقل المتماثلة الأشكال isoforms عند الثدييات. تقوم مبادلات (الهيدروجين – صوديوم) بدور مسيطر في تنظيم الكالسيوم داخل الخلوي وبالتالي تنظيم قوة تقلص القلب. غالباً ما يتعلق التأثير العلاجي للغلوكوزيدات القلبية بإنقاص تبادل (الصوديوم والكالسيوم) بالقلب الناتج عن انخفاض مدروج (الصوديوم –هيدروجين) عبر الغشاء الخلوي.
- بروتينات النفوذية السكرية: Permeability glycoprotein
بروتينات النفوذية السكرية (بارا- بروتين سكري) (p-glycoprotein) هي عبارة عن مضخة خارجية معتمدة على ATP مسؤولة عن ضخ المواد لخارج الخلايا، وتدخل في تطوير المقاومة للدواء بالخلايا الورمية tumor cells. إن توّضع بارا- بروتين سكري في الأغشية القمّيةapical membranes للأمعاء والكبد وخلايا الكلية وأيضاً في الحاجز الدموي الدماغي blood brainbarrier يسبب إمكانية إحداث هذه المضخة لتأثير عميق على امتصاص وتوزع وإطراح الدواء، كما في التآثرات الدوائية (دواء- دواء). الاحتساء والالتقام: Pinocytosis and Endocytosis إن الاحتساء عبارة عن طريقة غير نوعية تدخل بواسطتها الركيزة (substrate) إلى الخلايا عن طريق الانغلاق invagination ليشكل حويصلة داخل خلوية (intracellular vesicle) . يحدث الالتقام المتواسط بالمستقبلات (Receptor-mediated endocytosis)عندما ترتبط الركيزة بمستقبل غشائي نوعي. تلتهم الركائز بهذه الطريقة من قبل الخلية وتخزن في الحويصلات(vesicles) أو تتحلل (degraded). يتم تخزين أو تدرّك الركائز التي التهمتها الخلية بهذه الطريقة. يشتمل الالتقام المتواسط بالمستقبلات ضمن القبط الخلوي للغلوبولين المناعي والبروتين الشحمي منخفض الكثافة.
- تأثيرات عوامل المستحضر في امتصاص الأدوية وتعزيز الامتصاص:
FORMULATION FACTORS AFFECTING DRUG ABSORPTION AND ABSORPTION ENHANCERS:
تؤثر تركيبة الدواء وخصائصه الفيزيائية والكيميائية على ثباتية الدواء وخصائص الامتصاص.
- العوامل الكيميائية : Chemical Factors
من الممكن استخدام العديد من الخيارات الكيميائية لتحسين الثباتية stability والتوافر الجهازي systemic availability للأدوية. على سبيل المثال: يمكن تحضير الاسترات من كل من الحموض والاسس لإنتاج مشتقات أكثر ثباتية والتي تتحلمه إلى المركب الفعال الأم فور امتصاصها . تميل الحموض والأسس لزيادة ثباتيتها وانحلاليتها عندما تتواجد بشكل أملاح، فتطبيق أملاح البنسلين المنحلة يرفع مستويات المضاد الحيوي الدورانية أكثر منها في حالته الحمضية الحرة. عندما يكون ملح الحمض الضعيف منحل في المعدة فإن ذلك سيولد طبقة انتشار بباهاء مرتفعة نسبياً والتي بدورها تزيد تعزيز الذوبان. ولنفس السبب تستخدم نظرياً للأدوية الأساسية. ومع ذلك فإن تأثير الباهاء في هذه المرحلة سيغمر في نتيجة وجود باهاء منخفضة جداً في سوائل المعدة. ونتيجة لذلك تستخدم أملاح الأدوية الأساسية بشكل رئيسي من أجل الإيداء handling والذوبانية solubility فضلاً عن تحسين الذوبان. العوامل الفيزيائية: Physical Factors تستطيع الأشكال الفيزيائية المختلفة للدواء أن تؤثر على امتصاصها. نموذجياً إن الشكل البلوري crystal ومتعدد الأشكال polymorphic و الحالة state أو طبيعة الاِنْذِيَاب solvation أو التَمَيُّه hydration و حجم الجزيئات الدوائية من الممكن أن يكون له تاْثير كبير على سرعة ومدى امتصاص الدواء. تعدد الأشكال وانعدام الشكل: Polymorphism and amorphism تشكل العديد من المركبات بلورات بترتيبات جزيئية مختلفة أو المُفَصَّصَات (متعددة الأشكال) polymorphs. من الممكن أن تملك هذه المُفَصَّصَات (متعددة الأشكال) خصائص فيزيائية مختلفة كسرعة الذوبان و الذوبانية. يوجد فيتامين الريبوفلافين (الفيتامين B2 ) riboflavin بنماذج متعددة الأشكال مختلفة كما لها 20 ضعف لقابلية مدى الذوبانية بالماء. إن متعددات الأشكال التي لاتملك بنية كريستالية crystal structure أو المنعدمة الشكل amorphic forms تملك خواص فيزيائية مختلفة عن الأشكال الكريستالية . تتحكم سرعة الذوبان بامتصاص الأدوية الفموية. تنحل الأشكال غير البلورية عموماً بشكل أسرع من الأشكال البلورية لأنها لاتحتاج إلى طاقة لتحطيم الشبيكات البلورية crystal lattice ولهذا السبب يفضل الشكل اللابلوري عن الشكل البلوري وتسوق الأدوية الأخرى مثل الهيدروكورتيزون hydrocortisone و البريدنيزولون prednisolone بشكلها عديم الشكل.
- الانذياب Solvation:
من الممكن أن تنضم واحدة أو أكثر من بلورات الدواء مع جزيئات المذيب أثناء التحضير وبذلك تتشكل المنذابات solvates. يعد الماء أكثر المنذابات شيوعاً. إذا كانت جزيئات الماء موجودة بالشكل البلوري فإن بلورات الماء تميل إلى جذب الماء الإضافي وبذلك يبتدئ اختزال عملية الانحلال. وستميل بلورات المنذابات (المميهة) للانحلال بشكل أبطأ من الأشكال اللابلورية. وقد سجلت العديد من الاختلافات بسرعة الذوبان للأشكال المميهة واللابلورية للأمبيسلين والكافئين والتيوفللين والغلوتيمايد والمركابتوبورين. ولم يتم اختبار المدلول السريري لهذه الاختلافات لكن يبدو أنها قليلة التأثير.
- حجم الجزيئات: Particle size
يقوم حجم الجزيئات بدور كبير في امتصاص الدواء. يكون معدل ذوبان الجزيئات الصلبة متناسب مع مساحة السطح وبالتالي مع نعومة fineness الجزيئات. يستخدم إنقاص حجم الجزيئات لزيادة امتصاص عدد كبير من الأدوية قليلة الانحلال كالديكومارول bishydroxycoumarinوالدِيجوكسِين digoxin و الغرِيزيوفولفين griseofulvin و النتروفورانتوئين nitrofurantoin والتولبوتاميد tolbutamide . إن غرِيزيوفولفيِن Griseofulvin ذو ذوبانية منخفضة جداً بالماء وحجم الجزيئات المادية يؤدي إلى فقر وعدم انتظامية بالامتصاص. يقوم حجم الجزئيات المكروية بزيادة الامتصاص ولكن تحسينه هذا يكون أكبر عندما يكون مصيغ بفوق بجزيئات فوق الحجم المكروي ultramicrosize كبعثرة dispersion أحادية الجزيء monomolecular غليكولٌ بولي إيِثيلين polyethylene glycol.
- عوامل الصياغة (المستحضرات): Formulation Factors
لقد تم تصميم المستحضرات الدوائية بحيث توفر الجاذبية attractive و stable والملاءمةconvenient لاستخدام المنتجات. من الممكن وصف الأشكال الجرعية الاعتيادية بصورة عامة بالاعتماد على انخفاض معدل الذوبان كمحاليل solutions ومحاليل صلبة solidsolutions ومستعلقات suspensions وكبسولات capsules وأقراص tablets والكبسولات والأفراص المغلفة والصيغ مضبوطة التحرر.
- المحاليل: solutions
لاتقدم المحاليل المائية Aqueous solutions والشرابات syrups والأكاسير elixirs والمستحلبات emulsions مشاكل أثناء الذوبان وتسبب عموماً امتصاص سريع وتام عادةً بالمقارنة مع الأشكال الجرعية الصلبة. حيث تستخدم المحاليل عادةً كمقياس للتوافر الحيوي بسبب توافرها الجهازي الجيد عادة مقابل الأشكال الجرعية الأخرى المقارنة. المحاليل الصلبة: solid solution إن المحاليل الصلبة عبارة عن صيغة حيث يتم احتباس الدواء كمحلول صلب أو كبعثرة أحادية الجزيء monomolecular dispersion ضمن مطرس matrix منحل بالماء. بالرغم من أن المحاليل الصلبة طريقة فعالة لزيادة امتصاص الدواء فإن فهناك دواء واحد فقط يسوق حالياً بهذا الشكل وهو الغرِيزْيوفولفِيِن griseofulvin .
- المستعلقات: Suspensions
يكون الدواء في المستعلقات بالشكل الصلب ولكن تصنيعه بشكل ناعم (دقيق)، أعطاه مساحة سطحية واسعة. تستطيع جسيمات الدواء الانتشار بسرعة بين المعدة والأمعاء الدقيقة مما يجعل الامتصاص غير حساس بشدة لسرعة الانفراغ المعدي.
وبشكل مشابه للمحاليل فإن المستعلقات مفيدة للمرضى الذين لديهم صعوبة بتناول الدواء الصلب. يكون ضبط الجرعة تبعاً لحاجة المريض أسهل في المحاليل والمستعلقات بشكل أكبر من الأشكال الجرعية الصلبة. وبناء على ذلك تملك الأشكال الجرعية السائلة العديد من الفوائد العملية بالإضافة لسرعة الذوبان البسيط. وبالرغم من ذلك هناك العديد من المساوئ التي تتضمن حجم أكبر وصعوبة الإيداء (التعامل) وربما الثباتية المنخفضة.
- الأقراص والكبسولات : Capsules and tablets
تعد الأقراص والكبسولات أكثر الأشكال الجرعية الفموية شيوعاً. تختلف هذه المستحضرات عن بعضها في أن المواد ضمن الكبسولات تكون أقل تأثراً بالوسط من الأقراص المضغوطة compressed tablets. ما إن تنحل الكبسولة، يحدث تبعثر سريع للمكونات. بالرغم من أن مادة الكبسولة تنحل في الماء فإن تستطيع أن تعترض ذوبان الدواء عن طريق تآثرها مع الدواء لكن هذا ليس شائعاً. عادة تتحلل الأقراص على عدة مراحل، حيث تتحول أولاً إلى حبيبات (حثيرات) granules ومن ثم إلى جسيمات أولية primary particles. وكلما نقص حجم الجزيئات، يزداد معدل الذوبان نتيجة ازدياد مساحة السطح. يعتبر تفكك الأقراص معيار كاف للتنبؤ بالامتصاص الحيوي ضمن الجسم. وقد كان يعتبر كمعيارغير كافٍ وقد تم اعتبار الذوبان كمعيار أفضل الآن. تفرض الهيئات التشريعية Regulatory agencies حالياً بيانات معدل الذوبان الحيوي لجميع الصيغ الفموية الجديدة. إن القبول الواسع المتزايد للذوبان على أنه أفضل مُتَثابِتَة parameter حالياً في الزجاج للتنبؤ بالامتصاص الحيوي ينعكس في تزايد هذه الاختبارات في الخلاصات الرسمية. السواغات Excipients. مع المواد الفعالة الموجودة في الأقراص والكبسولات وتشكيلة مما يسمى بالمكونات الخاملة ومثال على ذلك: النشاء starchوسيليكات المغنزيوم والألمنيوم magnesium aluminum silicate والميتيل سيلولوز methylcellulose و الكَرْبُوكْسِي ميثيل سلولوز carboxymethylcellulose واللاكتوز lactose و الكاولين kaolin والطلق talc وسلفات الكالسيوم calcium sulfate وستيارات المغنزيوم magnesium stearate. تملك الأقراص ضروب من الأغلفة (التلبيس) وذلك لزيادة الثباتية وإخفاء المذاق وتحسين المظهر وخصائص تحرر الدواء. إن هذه المضافات بالرغم من أنها تعتبر خاملة فإنها تستطيع التأثير في ذوبان وامتصاص الدواء. إن تغيير السواغ من سلفات الكالسيوم إلى اللاكتوز وزيادة نسبة سيليكات المغنزيوم يؤدي إلى زيادة نشاط الفينتوئين phenytoin الفموي. ينخفض التوافر الجهازي للثيامين thiamine و الريبُوفْلاَفِين riboflavin بوجود تُرابُ القصَّارين Fuller’s earth. ينخفض امتصاص التتراسيكلين tetracycline من الكبسولات عن طريق فوسفات الكالسيوم نتيجة تشكيل المعقدات. لقد تم منذ زمن الإعلان عن معظم أنماط هذه التآثرات ولقد كان من غير المحتمل في البيئة الحالية للاختبارات الجارية للأشكال الجرعية والمستحضرات الحديثة.
- الأقراص الملبسة: Coated tablets
من الممكن أن تكون الأقراص مصيّغة مع الطبقات كالصَمْغُ اللَّكّ shellacو الرتين resin و بلمر حمض الماليك الستيرني المشترك styrene-maleic acid copolymer. تكون هذه الطبقات غير ذوابة في الحمض ولكنها تذوب بسرعة في الباهاء المعتدلة أو القلوية لذلك يتم استخدامهم بشكل مثالي لمنع تحرر الدواء حتى يعبر المستحضر من المعدة إلى الأمعاء الدقيقة. من الممكن أن يكون منع تحرر الدواء بالمعدة حامياً للدواء الذي يكون عطوب بالوسط الحمضي كما يمكن أن يحمي المريض من المواد المهيجة كأملاح الحديد والدي إيتيل ستيلبيستريول diethylstilboestrol وبعض العوامل المضادة للالتهاب anti-inflammatory agents. غالباً مايكون الإطلاق والتوافر الجهازي التابع للدواء من هذه الصيغ ذو حساسية عالية لأطوار الانفراغ المعدي. ترابط الاختبارات بالمختبر وعلى الأحياء: In Vitro–In Vivo Correlations. إن العلاقة بين الذوبان في المختبر (في الزجاج) in-vitro والتوافر الحيوي في الأحياء in-vivo ذو أهمية جديرة بالاهتمام في الوقت الحاضر. لقد تزعمت منظمة الغذاء والدواء الأمريكية (US FDA) البرنامج البحثي لاختبار العلاقات بين الأهداف وذلك من أجل كسب معرفة أفضل لعلاقاتهم المتبادلة ولاستخدام العلاقات كوسيلة للتنبأ لشكل الانجاز في الأحياء من المعلومات في المختبر . حيث أنّ إدراك الهدف الثاني سيوفر النفقات بشكل ملحوظ. سيكون من المهم معرفة مدخرات تحقيق هذا الهدف الثاني. لقد بنيت هذه الدسرة من الأبحاث في هذه المنطقة على الاختلافات بين الأدوية أو المستحضرات من ناحية الذوبانية و النفوذية الغشائية.[11]
من الممكن أن تصنف الأدوية أو المستحضرات في أربع مجموعات : 1) ذات الذوبانية العالية والنفوذية القليلة 2) ذات الذوبانية العالية والنفوذية العالية 3) ذات الذوبانية المنخفضة والنفوذية العالية 4) ذات الذوبانية المنخفضة والنفوذية المنخفضة. إن الأدوية في المجموعة الثالثة سيكون الذوبان هو المحدد لسرعة الامتصاص وستكون معلومات الذوبان في المختبر ذات فائدة، ومن ناحية أخرى ففي أدوية المجموعة الأولى ستكون النفاذية هي الخطوة المحدّدة على الأرجح وستكون بيانات المختبر أقل فائدة. وبالنسبة للمجموعة الثانية والرابعة فتكون الصورة أقل وضوحاً وتكون العلاقة بين الاختبارات على الأحياء – في المختبر ذات ضرورة للتحديد بشكل تجريبي .
- صيغ التحرر المضبوط: Controlled Release formulations
إن تقييم فوائد الأدوية ذات التحرر المضبوط وتطوير العديد من أنظمة التحرر المضبوط الجديدة والاهتمام أيضاً بالمؤسسات الصيدلانية التجارية pharmaceutical houses في حماية المنتجات الصيدلانية المسوّقة قد أدت لزيادة الاهتمام بهذا النوع من الأشكال الجرعية. تتضمن معظم المنتجات ذات التحرر المضبوط المسوقة حالياً العوامل المدّرة للبول diuretic agents والأدوية التنفسية respiratory و أدوية الجهاز القلبي الوعائي cardiovascular والمركبات المؤثرة في الجهاز العصبي المركزي CNS كما تم توجيه قليل من الاهتمام تجاه العوامل المضادة للميكروبات antimicrobial agents
- إيجابيات الأدوية ذات التحرر المضبوط: Advantages of Controlled Drug Release
تكون الأشكال الجرعية ذات التحرر المضبوط مسوّغة فقط إذا كانت تبدي فوائد علاجية وذلك بسبب تكلفتها المرتفعة عموماً أي تقوم بـ: تحسين الحفاظ على مستويات الدواء العلاجية في الدوران و الإقلال من تكرار الجرعة ومن تأرجح fluctuation مستويات الدواء الدورانية كما أنها أكثر ملاءمة للمريض وتقليل مدة العناية بالمريض وبجرعات أقل أثناء الليل واستجابة دوائية موحدة أعلى و إقلال التهيج في الجهاز الهضمي وإنقاص التأثيرات الجانبية. وقد حرض الأمر الثاني (الإقلال من تكرار الجرعة) على تطوير أشكال جرعية مضبوطة التحرر. ولكنه أصبح غير مقبول كمعيار وحيد. ومن المفهوم التأكيد الحالي على احتواء التكلفة current emphasis بالرعاية الصحية.
- مساوئ الأدوية ذات التحرر المضبوط: Disadvantages of Controlled Drug Release
تتضمن المساوئ المحتملة للأدوية ذات التحرر المضبوط إمكانية إغراق الجرعة dose dumping وأقل سهولة في إحكام الجرعة وازدياد إمكانية الاستقلاب بالمرور الأول الكبدي وإمكانية التأخر في بدء الفعالية واحتمالية انخفاض التوافر الجهازي والحد من زمن إطلاق الدواء في مناطق الامتصاص المثلى في السبيل الهضمي.
إغراق الجرعة، أو الإطلاق السريع المهمل للدواء هام للأدوية الفعولة potent drugs التي تملك فهرس علاجي ضيق. تنقص ممارسات التصنيع الجيد (GMP) إمكانية حدوث هذا. يكون إحكام الجرعة الناعمة (الدقيقة) غالباً صعب في صيغ التحرر المضبوط. من الممكن أن تقسم الأقراص ذات التحرر المضبوط والتي تستخدم مطرس الحبيبات granule matrix من أجل إنقاص الجرعة ولكن تفقد أقراص الفعالية المتكررة repeat action tablets أو جهائز المضخات التناضحية osmotic pump devices خواصها ذات التحرر المضبوط حالما يتفتت الشكل الجرعي. قد يحدث ارتفاع في الاستقلاب الأول الكبدي مع الأدوية التي تتم تصفيتها بالكبد ولكن فقط إذا كان التصفية الكبدية قابلة للاشباع بعد الامتصاص السريع من الأشكال الجرعية الاعتيادية. يكون انخفاض التوافر الجهازي شائعاً في الأشكال الجرعية ذات التحرر المضبوط ويكون التوافر الاعتيادي بنسبة 80-85 % من المستحضرات الاعتيادية. كما أن زمن الإقامة المحددresidence time في السبيل الهضمي هو من المساوئ المحتملة للمنتجات الفموية ذات التحرر المضبوط وهذا مايميز الشكل الفموي عن الأشكال الجرعية الأخرى ذات التحرر المضبوط (مثل: اللصاقات الجلدية التي يمكن أن توفر تحرر بطيء للدواء لمدة طويلة).
- الأدوية غير المناسبة للتحرر المضبوط:
يوجد بعض الأدوية غير الملائمة لصيغ التحرر المضبوط . نموذجياً تتضمن ميزات هذه الأدوية :عمر النصف البيولوجي قصير وعمر النصف البيولوجي طويل و الأدوية الفعولة potent drugs ذات الفهرس العلاجي الضيق وذات الجرعة الكبيرة وضعيفة الامتصاص وذات الذوبان البطيء أو القليل والامتصاص الفاعل و زمن مساق النشاط ليس تماماً مثل مستويات الدواء الدورانية واستقلاب المرور الاول الكبدي الواسع. إن الأدوية ذات الشكل الجرعي مضبوط التحرر والتي تملك عمر النصف البيولوجي أقل من ساعتين أو التي تطبق بجرعات كبيرة تحتاج إلى أن تحتوي كمية كبيرة من الدواء بشكل محظور prohibively. توفّر الأدوية ذات عمر النصف البيولوجي الطويل (أكثر من 8 ساعات ) عادة إطلاق مديد بما فيه الكفاية في الجسم بالجرعات العادية فلا نحتاج لأنظمة تحرر مطوّل. إن إضافة مركبات قليلة الذوبان إلى صيغ التحرر المضبوط غير إيجابي لأن الذوبان هو الخطوة المحدّدة دائماً. إن تطبيق الأدوية كالوارفارين warfarin ذو التأثير الدوائي المديد نسبةً إلى مرتسمه الدموي،لا يقدم أي فوائد علاجية. إن دمج مثل هذه المركبات كبعض المضادات الحيوية من زمرة البيتا لاكتام beta-lactam والفلورويوراسيل fluorouracil وبعض من الحموض الأمينية amino acids التي يبدو على أنها تمتص بالدرجة الأولى من المعي الدقيق الداني سيقلل نجاعتهم efficacy وسيوفر القليل من التأثير المطوّل أو حتى قد لا يؤثر. وكما ذكر سابقاً، فإذا اجتاز الدواء المرور الاول الكبدي القابل للإشباع بالجرعات الاعتيادية، فمن الممكن أن ينقص توافره الجهازي بعد التحرر المضبوط. بالرغم من أن النقاش المذكور آنفاً قد زوّد بقواعد عامة مفيدة فإنه هناك العديد من الاستثناءات. فعمر النصف البيولوجي biological half-life للنتروغليسرين Nitroglycerin أقل من نصف ساعة. ويعتبر كدواء ضعيف الامتصاص واستقلابه الكبدي سريع عبر المرور الأول. ورغم ذلك يسوّق عدد كبير من المنتجات المضبوطة فموياً من النتروغليسيرين. يبدو أنّ المستويات الدورانية المنخفضة من النتروغليسرين الناتجة عن هذه المنتجات توفّر توقية prophylaxis كافية من نوبات الذبحة angina attacks ولكن ليس من نوبات الذبحة الحادة. يبين الجدول -1- العديد من الأشكال الجرعية مضبوطة التحرر المسوّقة حالياً.[12]
معززات الامتصاص: absorption enhancers
على الرغم من أن التجريع الفموي أكثر ملاءمة من طرق تطبيق الجرعات الأخرى، فإنّ الامتصاص الفموي قليل في العديد من الأدوية. ولأن الجزيئات أصبحت أكبر وأكثر تعقيداً وعموماً أكثر ألفة للدسم لتطوير وتحسين نجاعة الدواء فإن امتصاصهم سيقلّ. ولمعالجة هذه المشكلة، ما زالت تجرى الاختبارات على معززات الامتصاص وتلقى نجاح متنوع.
إن المركبات التي تم عرضها إلى حد كبير في الدراسات الحيوانية من أجل زيادة امتصاص الأدوية تم عرضها في الجدول-2- . [13] يتوفر القليل من المعلومات أو لا يتوفر حول هذه المركبات على الجسم البشري
- عوامل مضادات الالتهاب غير الستروئيدية (NSAIDs) :
تستطيع NSAIDs وبالتحديد إندوميثاسين indomethacin و ديكلوفيناك diclofenac و الميبرازول mepirazole والفينيل بوتازون phenylbutazone والساليسيلات salicylate تحسين امتصاص أدوية أخرى منها الأنسولين insulin والأمبيسيلين ampicillin والسيفالوتين cephalothin والسيفُوكْسيتين cefoxitin والسيفيميتازول cefmetazole. إن معظم هذه المشاهدات لوحظت على الجرذ وكثيراً بعد الإعطاء المستقيمي. إن معظم الآليات التي تتم عن طريق NSAIDs تقوم بتحسين الامتصاص المسلمة ولكن لم تعرف الآليات الدقيقة. بما أن NSAIDs غالباً ماتكون مهيجة لمخاطية المعدة وربما يعود ذلك إلى قدرتها على تعزيز الامتصاص، فإنّ الفائدة من استخدامها في تحسين امتصاص الدواء غير مؤكدة.
التوافر الحيوي Bioavailability
التوافر الحيوي (بالإنجليزية: Bioavailability) هو كمية الدواء التي تصل للدوران بشكل كيميائي غير متغير، والتوافر الحيوي يعكس الفعالية والتأثير للمادة الدوائية، فكلما كان التوافر الحيوي أكثر كان التأثير أفضل.
الكافؤ الحيوي Bioequivalance
نقول عن مركبين أنهما متكافئان حيوياً بشرطين:
- أن يكون لهما التوافر الحيوي نفسه.
- أن يكون الزمن اللازم للوصول إلى التركيز الذروي في البلازما نفسه.
التكافؤ العلاجي Therapute equivalence
نقول عن مركبين أنهما متمافئان علاجياً، عندما:
- يكونان متكافئان حيوياً.
- أن يحققا معاً نفس شروط الأمان و الابتعاد عن التأثيرات السمية.
إقرأ أيضاً